MANGAN – metal szarobiały o różowym odcieniu, twardy, kruchy. Na powietrzu pokrywa się ochronną warstwą metalu. Metal aktywny chemicznie. Silnie rozdrobniony łatwo się utlenia, może nawet ulec samoistnemu zapaleniu.
Nie występuje w przyrodzie w stanie wolnym, związki manganu stanowią zanieczyszczenia rud żelaza.
Mangan jest pierwiastkiem należącym do 7. grupy układu okresowego pierwiastków. Z jego konfiguracji elektronowej:
25Mn: [Ar] 3d54s2
wynika, że atom manganu ma siedem elektronów walencyjnych, opisanych pięcioma orbitalami atomowymi typu 3d oraz orbitalem typu 4s. Może więc w związkach chemicznych występować na stopniach utlenienia od I do VII, ale najtrwalsze są związki chemiczne manganu na II, IV i VII stopniu utlenienia.
W zależności od stopnia utlenienia związki chemiczne manganu mają różne właściwości.
|
Stopień utlenienia manganu |
II |
IV |
VI |
VII |
|
Przykłady związków chemicznych |
MnO Mn(OH)2 |
MnO2 |
K2MnO4 |
KMnO4 |
|
Właściwości kwasowo – zasadowe |
zasadowe |
amfoteryczne |
kwasowe |
kwasowe |
|
Właściwości redukująco – utleniające |
redukujące |
redukujące |
utleniające |
utleniające |
|
Barwa |
bezbarwna |
brunatna |
zielona |
fioletowa |
Mangan stosuje się:
-
w metalurgii jako dodatek utwardzający do stopów metali;
-
jako katalizator w niektórych reakcjach chemicznych;
-
jako środki dezynfekujące oraz do produkcji barwników (związki chemiczne manganu);
Mangan jest niezbędnym do życia mikroelementem, wpływa na prawidłowe funkcjonowanie mózgu i dobry stan skóry. Jest jednym ze składników kości. Zapobiega osteoporozie i chroni przed zapaleniem stawów. W dużych ilościach sole manganu są toksyczne, a ich nadmiar może sprzyjać rozwojowi demencji, schizofrenii oraz pogłębiać chorobę Parkinsona.
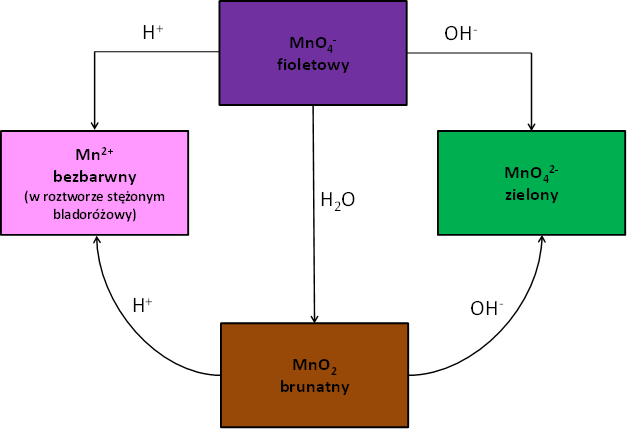
Związki manganu na VII stopniu utlenienia są silnymi utleniaczami. To jaki związek manganu powstanie w wyniku redukcji zależy od środowiska w którym przeprowadzamy proces: